深圳市艾斯基因科技有限公司
4 年
手机商铺
- NaN
- 0
- 1
- 0
- 3
推荐产品
公司新闻/正文
中国医学科学院肿瘤医院王洁团队、复旦大学附属中山医院樊嘉院士团队及燃石医学团队合作发文丨甲基化联合蛋白新策略助力多癌早检新突破
350 人阅读发布时间:2025-10-15 16:51
尽管基于循环游离DNA(cfDNA)甲基化检测的多癌种早筛血液检测(MCDBTs)已成为主流方法,但整合蛋白质与基因突变检测以提升其性能的潜力尚不明确。
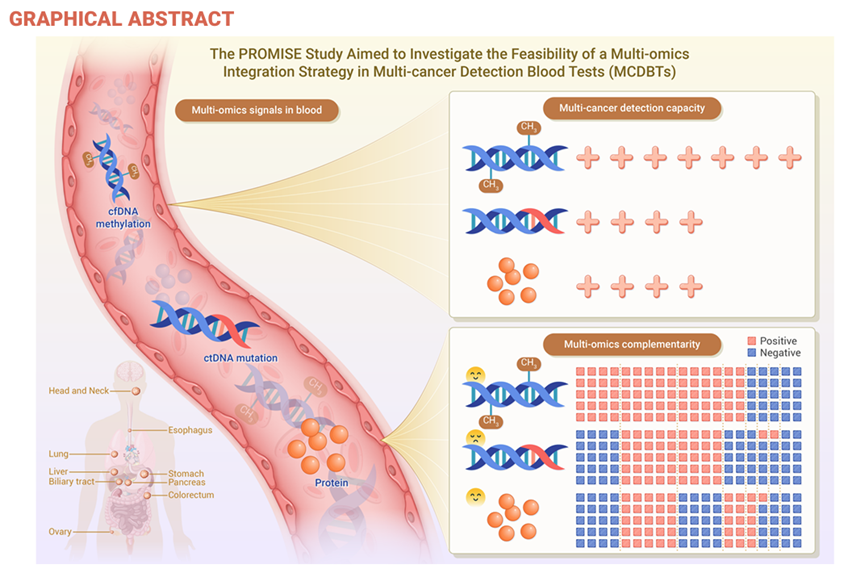
为填补这一空白并探索多组学整合策略的可行性,中国医学科学院肿瘤医院王洁教授团队、复旦大学附属中山医院樊嘉院士团队与燃石医学合作,针对九种高发高死亡率癌种开展了前瞻性多中心病例对照研究(PROMISE,NCT04972201),包括头颈(不含鼻咽癌)、食管、肺、胃、肝、胆道、胰腺、结直肠和卵巢癌,收集1706名参与者的血液样本,旨在探究多组学整合策略在MCDBTs中的可行性。研究成果于近期在《The Innovation》(IF=25.7)上发表,结果显示,基于甲基化的分类器性能优于基于突变和基于蛋白质的分类器,且蛋白质标志物或可为基于甲基化的分类器提供互补价值。研究数据表明,在多模态分类器中整合蛋白质和甲基化标志物可带来额外获益,尤其在肝癌和卵巢癌的识别方面效果显著。

Public summary
-
PROMISE研究探索了用于多癌症早期检测的多组学液体活检策略;
-
蛋白质在癌症检测中相较于基因突变,与甲基化检测展现出更强的互补性;
-
整合甲基化和蛋白质的多模态分类器表现出卓越的性能;
-
年度筛查可能通过将癌症分期从晚期转向早期,从而降低癌症死亡率
研究设计
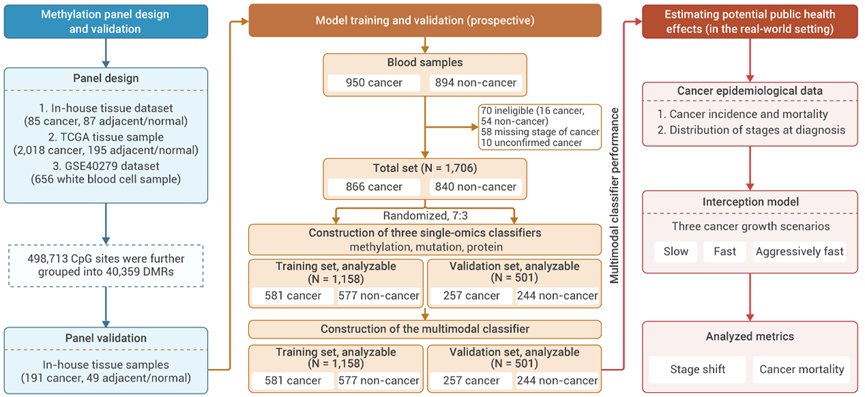
研究共收集了1706名参与者的血液样本(840例为非癌症患者,866例为癌症患者),并以 7:3 的比例随机分为训练集和验证集,两者之间参与者的基线特征相似。研究主要包含四个步骤:1)甲基化检测Panel的开发和验证;2)单一组学分类器的构建;3)分析单一组学分类器间的互补性以确定最优组合策略;4)多模态分类器的构建与优化。本研究主要目标是基于cfDNA甲基化、突变和血清蛋白标志物的多组学特征,开发一种能区分癌症与非癌症样本的最优多模态分类器。
PROMISE研究流程图
主要结果
第一阶段:甲基化靶向panel开发与验证
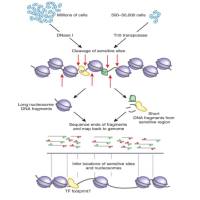
首先,研究人员通过整合内部和公共数据集中的组织甲基化检测数据,共筛选出498,713个九种癌症特异性的CpG位点,共覆盖40,359个差异甲基化区域(DMRs)。基于此进一步设计了一个定制化的靶向甲基化panel。
为了验证该panel的癌症检测和组织溯源能力,研究人员使用另一个组织数据集进行验证,通过UMAP分析,将邻近/正常组织和来自不同来源的癌症组织紧密分组,证明该panel在癌症检测和溯源癌症方面表现出色,将用于后续cfDNA甲基化检测。
第二阶段:构建血液单一组学模型
研究人员分别使用三个组学数据单独构建血液癌症早检模型,模型性能如下:
甲基化模型在训练集和验证集中分别为特异性分别为97.9%和98.8%,灵敏度分别为70.1%和71.2%,首要溯源器官(top predicted origin, TPO1)准确率分别为74.4%和72.7%。
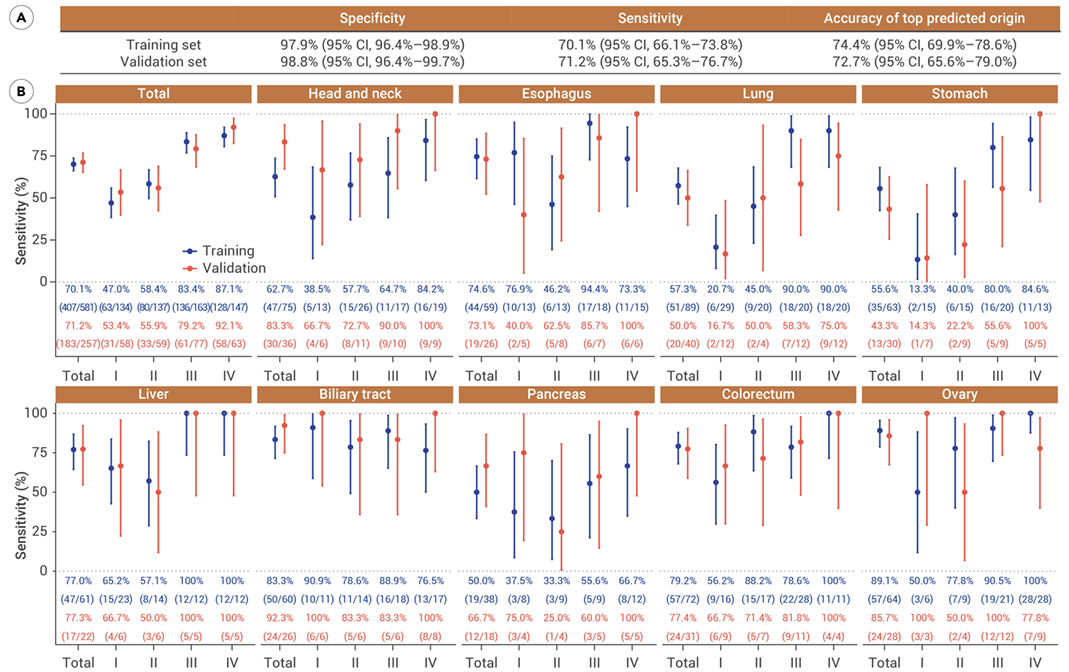
基于甲基化模型的性能评估
基于蛋白的肿瘤标志物模型在训练集和验证集中特异性分别为98.4%和98.8%,灵敏度分别为39.3%和42.3%,;突变模型在训练集和验证集中特异性分别为99.1%和100.0%,灵敏度分别为45.6%和45.2%。随着癌症分期的进展,基于蛋白质的分类器和基于突变的分类器的敏感性都会增加。
通过性能比较,甲基化模型的综合性能优于蛋白肿瘤标志物和突变模型。
第三阶段:单一组学模型的互补性分析
研究人员进一步深入分析了三种组学模型的互补性特征。研究结果显示,在甲基化模型可以检出的癌症样本中,突变模型比蛋白肿瘤标志物模型的阳性率更高;然而,在甲基化模型未能检出的癌症样本中,蛋白肿瘤标志物模型的检出率显著高于突变模型,能够识别出更多的癌症样本。针对不同肿瘤类型,在头颈部肿瘤、食管癌、肺癌和胃癌中,突变和蛋白肿瘤标志物模型的阳性率均较低(<20%);在其他癌症类型中,蛋白肿瘤标志物模型的阳性率高于突变模型(肝癌:75% vs 25%;胆道癌:60% vs 20%;胰腺癌:80% vs 20%;结直肠癌:20% vs 0%;卵巢癌:60% vs 40%)。
这些结果表明,与突变模型相比,蛋白肿瘤标志物模型作为非DNA来源的标志物检测模型,更适合作为甲基化模型的补充。
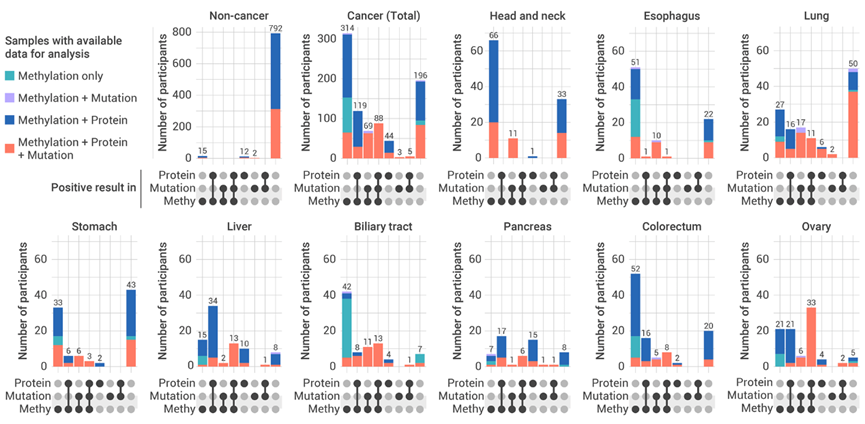
甲基化、突变和蛋白模型的互补性分析
第四阶段:多模态模型构建与优化
尽管突变模型的灵敏度和特异性总体上高于蛋白肿瘤模型,但二者存在显著重叠:基于突变的分类器检测出的癌症样本中,95.0%(151/159)也能通过基于甲基化模型同时识别。当与基于甲基化模型整合时,基于蛋白模型展现出检测更多癌症样本的能力,并可能提升肝癌和卵巢癌的定位准确性。
接下来,研究人员使用CatBoost算法整合甲基化和蛋白肿瘤标志物模型,开发了新的多模态模型,并通过五折交叉验证来优化模型参数,确保模型的稳定性和泛化能力。结果显示:
在验证集中,多模态模型性能显著优于甲基化模型,在特异性保持98.8%不变的情况下,将灵敏度从71.2%提升至75.1%(McNemar's test,P = 0.044),这种提升在I/II期和III/IV期癌症,以及肝癌、卵巢癌、胰腺癌中均有体现。在整体癌症溯源能力上,多模态模型与单一甲基化模型相当,但在肝癌和卵巢癌中,多模态模型的TPO1准确率分别达到了100%和96.4%。
最后,基于中国9大癌症类型的发病率和诊断分期数据,研究人员进一步模拟了年度多模态模型血液检测在真实世界中的性能和潜在获益。结果显示,在模拟不同的癌症生长模式下,与常规筛查方式相比,年度多模态模型筛查能够使48.8%-58.9%的癌症病例从晚期提早至早中期被发现,进而使5年癌症相关死亡率从64.3%降至49.3%-52.2%。
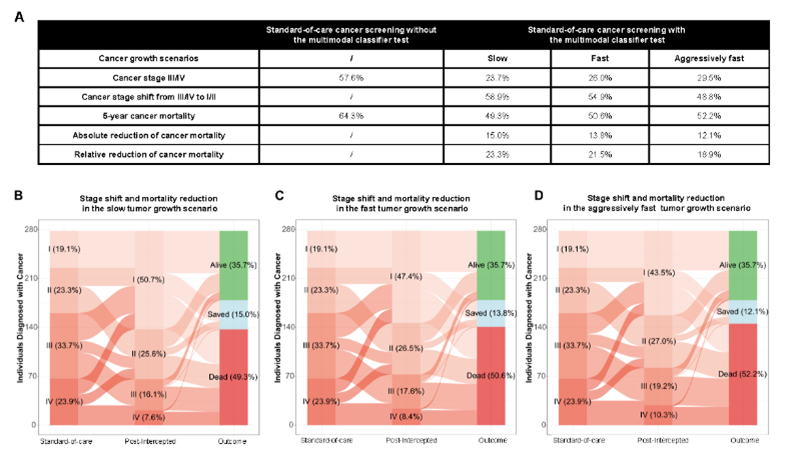
年度多模态模型筛查的获益评估
总结
关于艾斯基因
艾斯基因提供DNA甲基化、DNA羟甲基化、RNA修饰、ATAC-seq、Cut&Taq、Chip-seq、基因组、转录组、蛋白组、代谢组、暴露组等多组学产品服务,从实验设计—样本处理—生信分析—数据挖掘应用全链条参与您的方案,帮您高效避坑,突破难点!