深圳市艾斯基因科技有限公司
4 年
手机商铺
- NaN
- 0
- 1
- 0
- 3
推荐产品
公司新闻/正文
收藏!环境在基因上刻下的印记:暴露组学如何通过表观遗传重塑我们的健康
6165 人阅读发布时间:2025-09-05 17:51
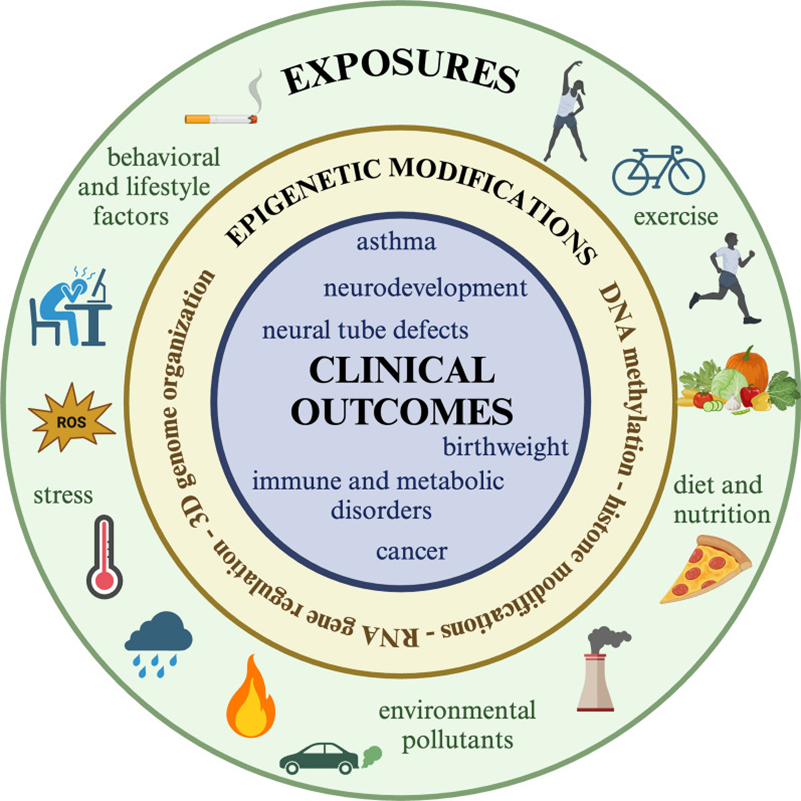
日常生活中,不良环境暴露是导致过早死亡的最大环境风险因素。它不仅与心脑血管疾病[1-2]、癌症[3]、神经系统疾病[4]、呼吸系统和代谢性疾病[5]等非传染性病的流行密切相关。还可通过表观遗传机制影响基因表达,进而影响生殖健康[6]、母婴健康[7]、生长发育[8]等健康问题。
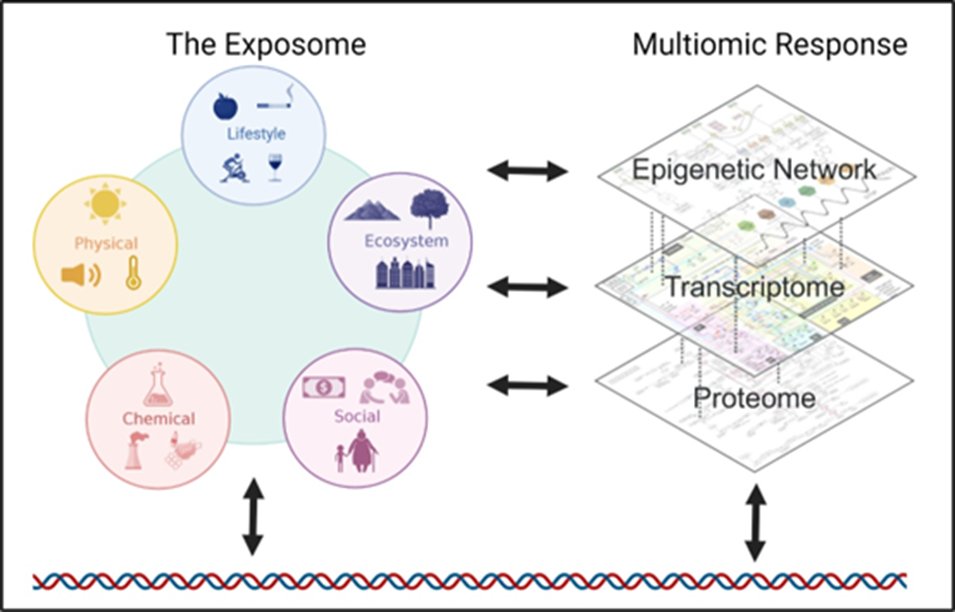
暴露组(exposome)是对环境影响的累积性度量,其范畴涵盖外部环境、生活方式、行为习惯、饮食结构以及由此引发的生物内源性过程。暴露组力求捕捉发现环境暴露的关键生物标志物以及它们相应的生物反应,从而探索有关暴露来源、剂量反应关系、作用机制、疾病因果关系和公共卫生干预的后续假设。
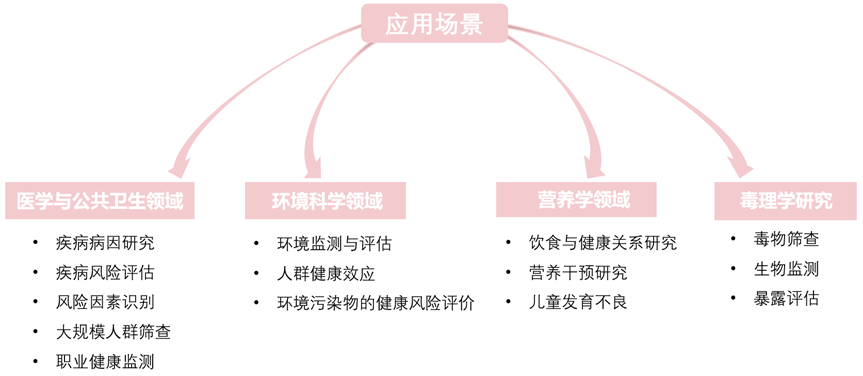
暴露组学应用场景
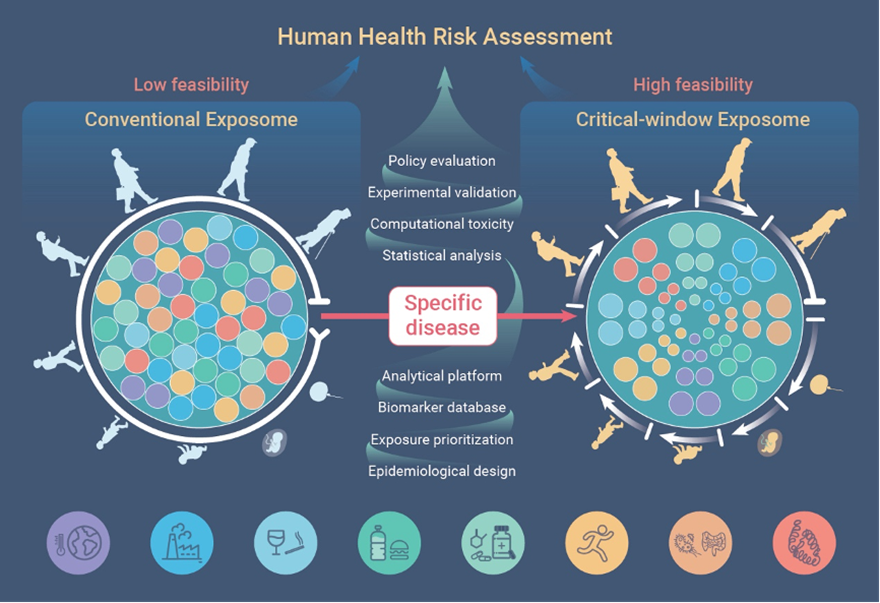
从传统暴露组学研究到关键窗口期暴露组学研究
暴露组会在每个生物学层级诱发相应反应,共同驱动疾病和不同健康问题的发生发展,因此探索暴露组对人类健康影响的途径较多。近年来,以Exposomics为关键词的研究文献快速增长,特别是在暴露组整合表观组学研究以研究疾病发生发展方面。这些研究更多集中在孕期相关不良妊娠结局、生殖健康、儿童发育不良、饮食与健康安全、职业暴露等健康问题,特别是胎儿、婴儿和儿童群体更容易受到暴露诱导的表观遗传变化的影响,因为他们的身体正经历快速生长(细胞分裂和增殖)和发育(功能水平和复杂性不断增加)过程。
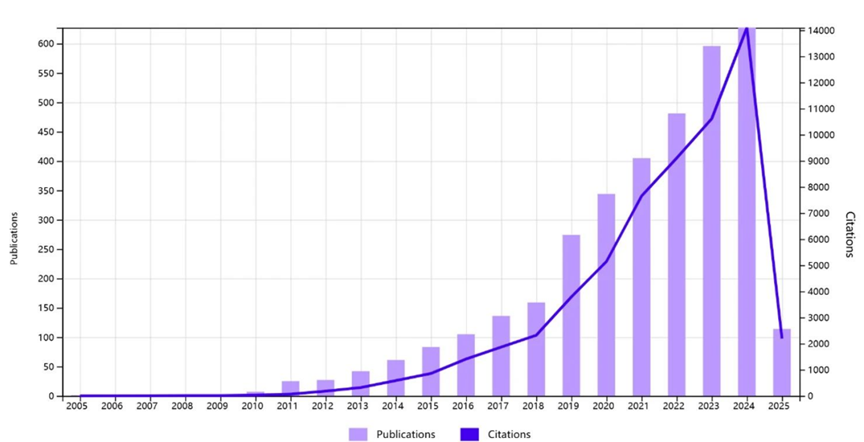
暴露组学相关的文献呈快速增长的趋势
本文旨在重点阐述暴露组和表观遗传学的相互作用与疾病健康状态之间的关系,以及表观遗传学在不良环境暴露相关研究中的实际应用。
基因组学、暴露组学和表观遗传学三者关系:底稿—记录官—编辑
如果把我们的生命比作一部巨著,那么:
基因组学提供的是最原始的底稿和字母表——它决定了故事的基本人物和所有可能用到的词汇(基因),这是与生俱来、相对固定的基础。
暴露组学则是一位孜孜不倦的记录官,它巨细无遗地记下主角(我们)一生所有的经历与环境:吸进的每一口空气、吃下的每一口食物、经历的每一次悲喜、承受的每一份压力。这些就是书写故事的“墨水”和“素材”。
表观遗传学,正是这部史诗的“编辑与排版”过程。它不改变底稿原有的字母(基因序列),但通过加上不同的“重点标记”(如DNA甲基化)、“段落折叠”(组蛋白修饰)等方式,来决定哪些章节被重点表达,哪些情节被暂时隐藏。
记录官(暴露组学)将一生的经历(暴露)交给编辑(表观遗传学),编辑则根据这些经历,对底稿(基因组)进行精妙的注解和排版,最终呈现出我们身体此刻正在阅读的、独.一无二的“生命故事”——即健康或疾病的状态。
简单来说:暴露组学是“因”,表观遗传学是“果”也是“桥”,它直接将环境的影响,翻译成了身体能读懂的基因调控指令。
表观遗传修饰如何构成构成环境暴露与疾病发病机制关联的基础?
表观遗传修饰调控基因表达,对开启或关闭基因以调节或维持分化细胞类型至关重要。表观遗传修饰会受到多种环境暴露的影响,这使其成为连接环境暴露与细胞改变(如基因表达的开/关、细胞活性的增强/减弱等)的理想生物机制,许多表观遗传修饰具有动态特征,既能反映个体生命周期中累积的环境暴露,又与衰老相关疾病和健康结局密切相关。早期环境暴露可能影响人类出生结果和长期健康的分子机制主要是通过表观遗传学的角度进行研究的,研究结果指出环境暴露可以通过改变DNA甲基化、组蛋白修饰等表观遗传修饰,通过干扰基因组稳态产生表观遗传毒性效应[5]。
当前,与表观遗传效应相关的环境暴露因素清单正迅速扩大。因此,将暴露组和表观遗传修饰多维数据整合应用,能系统解析环境暴露的时空动态特征与表观遗传调控网络之间的剂量-效应关系,从而在分子互作层面阐明环境驱动疾病发生的多阶段调控通路。
DNA甲基化
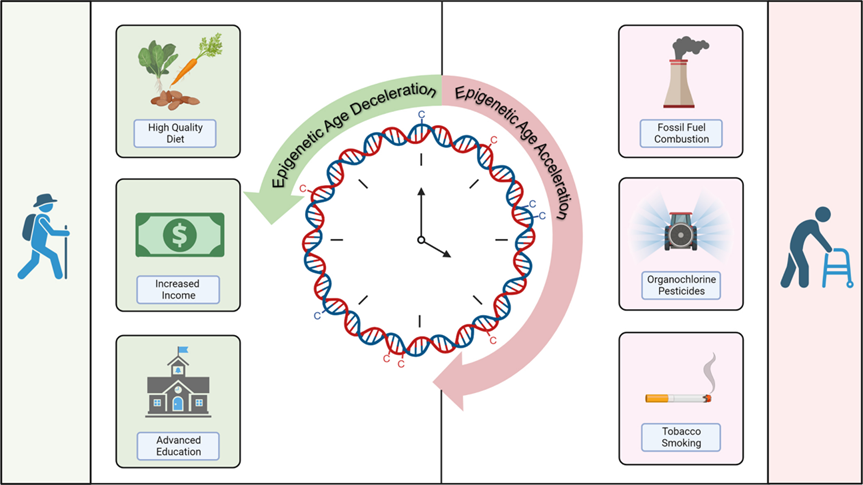
DNA甲基化是研究最广泛的表观遗传修饰,环境暴露可以通过影响DNA甲基化水平,进而调控基因表达并增加疾病风险。DNA甲基化的一个显著特征是其容易受到外部环境暴露因素的影响。研究显示,暴露于空气颗粒物(PM)[9-10]、烟雾[11]、金属[12-13]、内分泌干扰物(EDCs)[14]、NO2[15]、全氟和多氟烷基化合物(PFAS)[16-17]、双酚A(BPA)[18]、生活方式因素[19]、持久性有机污染物[20]及无机砷[21]等环境中,DNA甲基化会在全基因组范围和/或重复序列中发生甲基化水平的升高或降低,其中一些环境暴露与表观遗传年龄加速密切相关,且其中一些变化具有性别特异性和一定的持续性(有持续到青春期)。
组蛋白修饰
组蛋白为染色体提供结构支撑,而组蛋白修饰通过改变DNA与组蛋白的相互作用,从而影响基因表达,进而调节转录过程中的DNA可及性。尽管大多数组蛋白修饰在进化上高度保守,但组蛋白修饰的表观遗传机制也会受到环境因素的影响[22]。如砷暴露会改变组蛋白修饰模式,增加氧化应激和DNA损伤[23],新近研究表明,其他环境暴露同样可引发组蛋白修饰,包括:痕量金属[24]、空气污染物[25]、多环芳烃(PAHs)[26]、农药[27]、二噁.英[28]以及塑化剂[29]等。
非编码RNA
非编码RNA通过与靶基因直接相互作用,并与其他表观遗传机制协调响应,在转录水平发挥着关键的基因调控功能。miRNA作为一类重要的非编码小分子RNA,尽管其机制细节缺乏深入研究,但研究已证实miRNA对多种环境暴露存在响应,如重金属[30]、空气污染[31]、双酚A[32]。越来越多的证据表明,其他非编码RNA同样受到不良环境暴露的调控,如空气污染物会导致动物胚胎组织中出现差异性表达的环状RNA[33]。环境有害因素很可能改变大多数调控基因表达的RNA分子,最.新证据表明空气污染、金属暴露及其他环境污染物都会改变长链非编码RNA的表达[5]。这些研究趋势说明,必须进一步阐明环境有害因素如何影响非编码RNA的表达,以更全面的理解环境暴露影响人类健康的机制。
跨代遗传
多种模型生物的研究结果表明,暴露于有害污染物[34]、微塑料[35]、重金属及酚类物质[36]均可导致甲基化模式改变,有的在去除污染物暴露后至少持续了三代。说明这些暴露可能改变表观遗传修饰,从而导致环境影响基因表达和细胞功能,并产生持久的影响,这支持表观基因组在跨代传递环境暴露效应中发挥重要作用的假设,但进一步结论还需在人类队列中验证。相对于模型生物,对于临床样本研究表观遗传效应尽管存在更多挑战,但部分研究表明,父亲和母亲的暴露会影响DNA甲基化并传递给后代[37-38]。此外,多项研究提供了各种母体暴露导致后代DNA甲基化改变的证据。若环境暴露能通过表观遗传机制改变子宫内胎儿的体细胞并引发表型变化,那么它们很可能也会改变胎儿生殖系的表观遗传模式,为未来的跨代遗传奠定基础。
表观遗传修饰特征作为环境暴露的生物标志物
研究证据表明,表观遗传标记,特别是DNA甲基化或许能作为环境暴露效应的生物标志物,这体现在表观基因组易受环境影响,而这些暴露相关变化具有长期稳定性、在易获取生物样本中可检测、能预测暴露状态且具备实际应用价值。
与暴露相关的DNA甲基化变化显示出稳定性
稳定的表观遗传暴露标志物的存在可能克服现有暴露研究中半衰期较短的限制。既往研究中,可替宁和邻苯二甲酸单酯的半衰期均不足24小时,且由于可能需要在多个时间点收集生物样本,这使得评估既往暴露面临很大挑战。
可反映累积暴露的生物标志物有助于研究终身暴露与疾病之间的关系,暴露相关的表观遗传学特征或可作为稳定且实用的生物标志物,用于监测与环境暴露相关的机体变化,即使这些变化仅在暴露后数小时或数天内存在。例如,反映吸烟累积暴露的表观遗传学特征可辅助研究长期吸烟暴露与肺癌风险之间的关联。针对成人的研究表明,特定与吸烟相关的基因位点上的DNA甲基化水平可反映吸烟量(以包年为单位)及戒烟时间[39]因血铅半衰期短,故其测定值仅反映近期铅暴露情况,骨铅可反映数年内暴露情况,但成本高昂且负担较重。研究发现血液中长散在核序列1(LINE-1)的DNA甲基化水平已被证实与髌骨铅水平相关,这可能为铅的累积暴露提供更理想的替代方案[40]。与胎儿期暴露相关的DNA甲基化差异也可在更长的时间跨度内被检测到,加拿大学者通过近600人的队列研究证实母亲产前吸烟相关的DNA甲基化修饰可能在暴露子代中持续多年—至少持续至青春期阶段[41]。
以上这些发现支持DNA甲基化作为累积暴露生物标志物的潜在应用价值。
利用表观遗传学数据进行环境暴露的准确预测
DNA甲基化数据可用于准确预测环境暴露的实证依据,源自关于吸烟暴露成人中DNA甲基化水平与F2RL3等基因位点DNA甲基化水平之间剂量反应关系的详细研究,F2RL3和AHRR的DNA甲基化,以及影响基因表达的miRNA谱系变化——已逐渐成为诊断和治疗肺癌的重要指标。对于当前吸烟者,研究者观察到DNA甲基化水平与每日平均吸烟量之间存在显著负相关关系,而戒烟时间更长的个体DNA甲基化水平更高[42]。终身吸烟暴露的累积指标与铅暴露及DNA甲基化水平之间存在剂量反应关联[43]。除剂量反应关系外,还评估了与吸烟暴露相关的CpG位点DNA甲基化水平对准确分类样本至二分类暴露类别的能力。基于四个与吸烟相关的位点DNA甲基化值构建的分类器(平均在戒烟14年后测量),能够以71%的敏感性和0.83的AUC值预测吸烟者和从未吸烟者[44]。
经济高效的表观遗传学检测工具的可用性
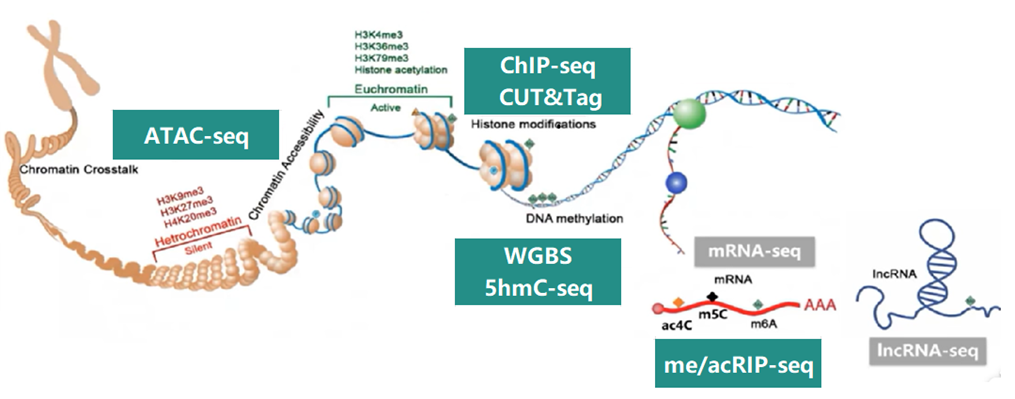
目前,DNA甲基化的检测技术愈加成熟,拥有多种可重复且准确的方案,包括全基因组甲基化测序(WGBS)、基于酶法转化(EM-seq)测序、简化甲基化测序(RRBS)、EPIC芯片以及EPIC测序等,能够满足从全基因组范围的高通量筛查到特定基因位点的精确定量,乃至全局甲基化水平评估等不同层次的研究需求。不同位点的DNA甲基化状态能通过高通量检测方式进行筛查,用于预测缺乏暴露史个体的既往暴露状况,且随着检测技术的发展。利用芯片数据开展的出生队列荟萃分析,正加速我们理解妊娠期环境暴露如何修饰新生儿及儿童甲基化组[45]。而WGBS、RRBS以及EPIC测序作为新一代测序技术,相比芯片能提供更广泛至全覆盖的所有可能CpG位点信息,在发现暴露相关表观遗传生物标志物方面同样具有巨大潜力,并已得到广泛应用。但广泛使用的芯片技术通过单次实验筛查大量位点,同样为该方向的研究提供着强大助力。
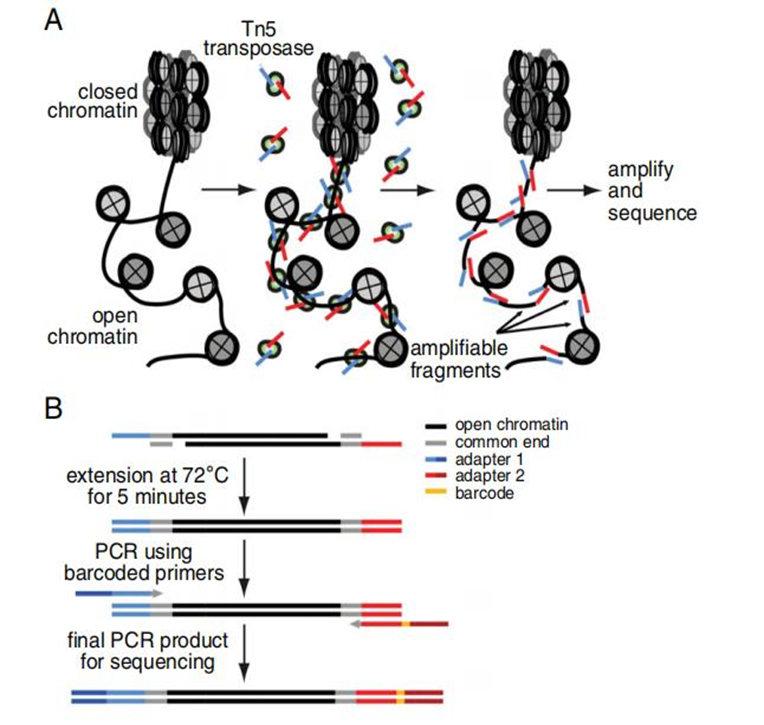
组蛋白修饰作为调控基因表达和细胞功能的重要机制,在疾病发生发展中发挥关键作用。当前研究已从基础机制探索向临床应用转化发展,特别是在肿瘤免疫治疗、神经系统疾病和心血管疾病等领域展现出广阔前景。组蛋白修饰研究技术不断发展,染色质免疫沉淀测序(ChIP-seq)、CUT&Tag、ATAC-seq等技术逐渐进入研究人员的视野并应用于高水平学术论文研究中。
暴露组学和表观遗传学的未来研究方向
表观基因组是连接环境暴露与短期及长期健康结果的桥梁。表观遗传修饰可通过响应环境信号调节基因表达,从而导致亚临床和临床表型的改变。一方面,表观基因组主要在胎儿期建立,而这一阶段是环境损伤最敏感和易受影响的时期。另一方面,表观基因组可在整个生命周期中发生改变,因此,许多早期生命暴露的健康影响具有潜在可逆性。表观遗传机制在新陈代谢、生长发育、大脑可塑性及健康维护中发挥重要作用,而暴露组可对此产生双向(积极或消极)调节效应。在这些背景下,表观遗传修饰可作为环境暴露、早期生物学效应、早期风险预测及早期干预新靶点的生物标志物。
尽管早期环境可影响表观遗传编程及远期疾病风险,表观基因组在推动暴露组学与精准环境健康领域仍具有巨大潜力,但这些关联的因果关联及多重暴露的复合效应仍有待全面阐明。随着暴露组领域的发展,利用表观遗传标志物作为既往暴露生物标志物甚至用于疾病防治已成为可能。但开发其他暴露或复合暴露的生物标志物,需要整合多队列生物样本资源与数据,构建可预测既往暴露的表观基因组替代图谱,识别暴露相关的表观遗传关联,对暴露诱导的表观遗传调控进行严格评估可以作为连接暴露组分析和疾病进展之间的桥梁。
随着我们将表观遗传学理解为整体环境(暴露组)与疾病发展的桥梁,相关研究可为临床治疗及宏观健康政策制定提供依据。即使暴露组和表观遗传学的整合研究尚处萌芽阶段,其未来必将为科学研究、临床实践和政策制定指引新方向。
案例分享
Placental DNA methylation signatures of prenatal air pollution exposure and potential effects on birth outcomes: an analysis of three prospective cohorts. Lancet Planetary health.IF=21.6(2024)
孕期暴露于室外空气污染是导致一系列不良新生儿结果的主要风险因素,并且是儿童心血管代谢疾病、呼吸系统疾病和神经发育障碍的原因。在这篇文章中,研究人员通过三个前瞻性母婴队列,共1539名参与者的胎盘样本,调查了空气污染暴露(PAPE)浓度与胎盘DNA甲基化模式变化之间的关联,并探索潜在的易感窗口期和性别特异性变化。研究结果显示三种空气污染物(PM2.5、PM10 和 NO2)对胎盘甲基化组的影响一致,并强调妊娠早期(主要是男婴)和妊娠晚期(主要是女婴)是胎盘表观基因组敏感性增加的窗口期。此外,妊娠期PAPE可能特别诱导胎盘甲基化组中与大脑、神经和免疫系统发育、新陈代谢有关基因发生改变。研究结果表明通过改变表观遗传机制,孕期空气污染暴露(PAPE)可能通过广泛的生物途径影响胎儿生长和神经发育,并表现出性别特异性和共同效应。
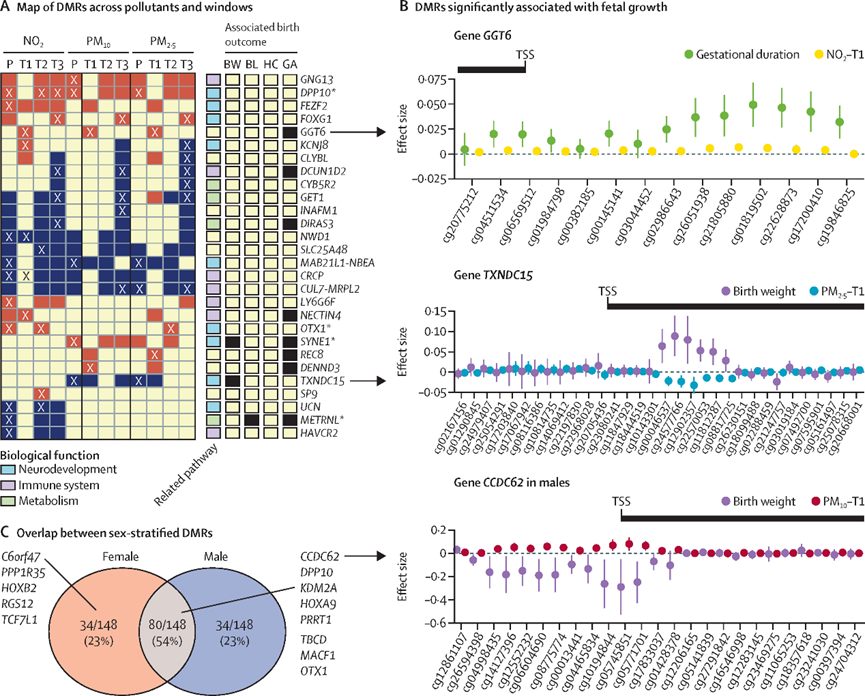
与孕期空气污染物暴露相关的胎盘差异甲基化区域
案例二:LXDC1基因的低甲基化可能介导全氟辛酸(PFOA)暴露与婴儿发育迟缓风险增加之间的关联
Prenatal exposure to per- and polyfluoroalkyl substances and DNA methylation in the placenta: A prospective cohort study.Journal of hazardous materials. IF=11.3(2023).
孕期PFAS暴露与儿童发育的多种不良健康结局相关,DNA甲基化被认为是孕期暴露于内分泌干扰化学物质(EDCs)对胎儿健康产生不良影响的潜在机制之一。研究人员基于345对母婴的血浆和胎盘组织样本,结合LC-MS/MS、简化代表性亚硫酸氢盐测序(RRBS)以及亚硫酸氢盐扩增子测序(BSAS)技术,研究孕期暴露于PFAS与胎盘DNA甲基化之间的关联,并探讨这种甲基化变化是否介导了PFAS暴露对婴儿发育的影响。研究发现,产前PFAS暴露会导致胎盘基因组DNA甲基化模式的改变,尤其在血管生成和神经发育相关基因中表现显著。特别值得注意的是,PLXDC1基因的低甲基化可能介导了PFOA暴露与婴儿发育迟缓风险增加之间的关联。
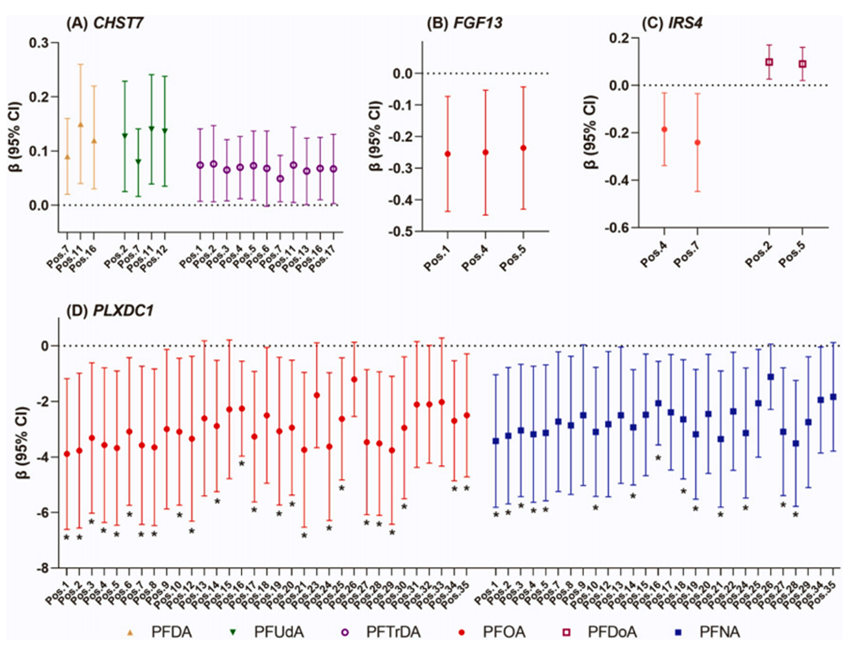
母体PFAS浓度与单个CpG位点的胎盘DNA甲基化水平之间的相关性
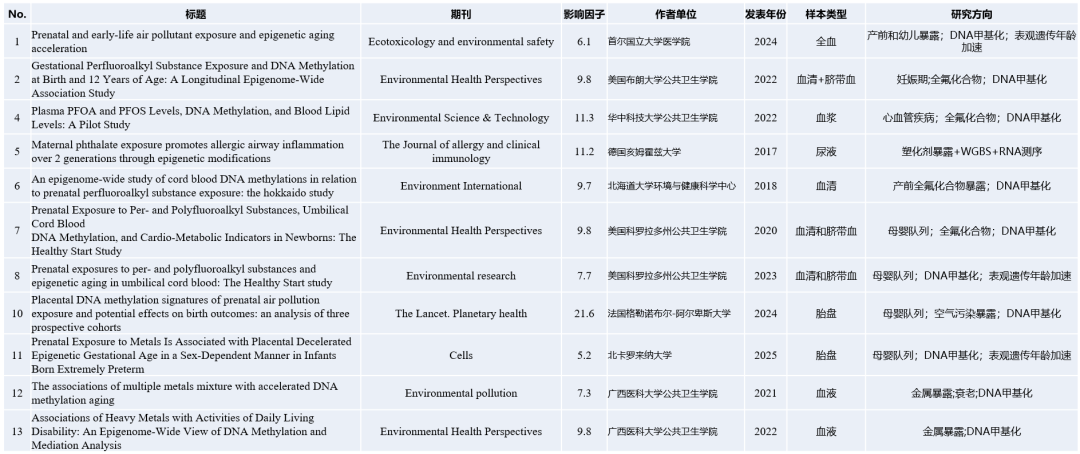
除上述案例以外,我们另外检索了部分暴露组学联合表观遗传修饰进行研究的高分文章案例,这些研究主要聚焦在母婴、生殖等健康问题,以供大家参考!
 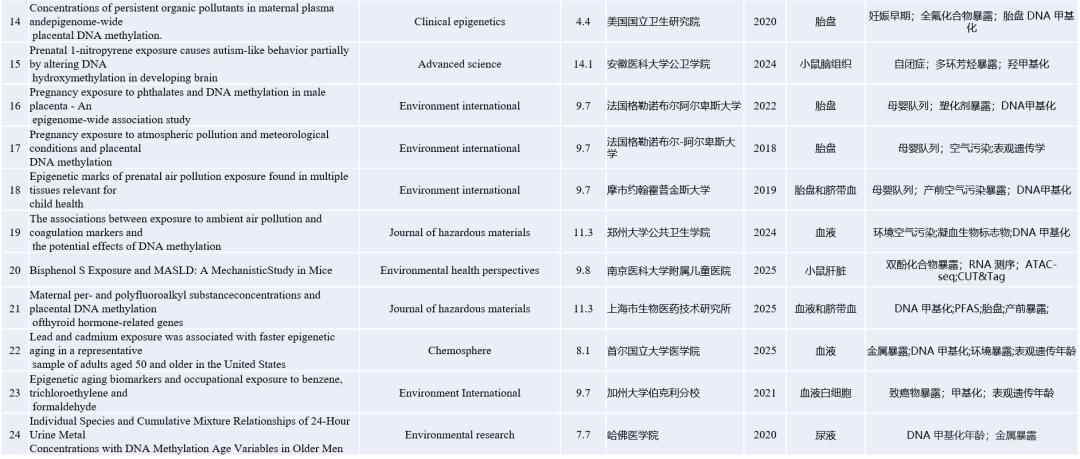 |
艾斯基因表观组学产品矩阵
艾斯基因具有完整的表观组学产品矩阵,入选美国《生命科学评论》杂志评选“亚太地区2025年最佳表观遗传多组学技术方案供应商”,产品覆盖DNA修饰、RNA修饰、组蛋白修饰/开放染色质等Bulk和单细胞多维度解决方案。Bulk表观组学包括DNA甲基化(WGBS、EM-seq、RRBS、935K芯片/测序、靶向甲基化TBS等)、DNA羟甲基化(5hmC-Seal、hMeDIP-seq、5hmC-seq等)、IP体系(ChIP-seq、m6A-seq等)、Tn5体系(ATAC-seq、CUT&Tag等)等。
艾斯基因全面助力精准医学及大健康研究
针对人群队列暴露组学研究,艾斯基因提供暴露组学系列产品(包括全氟类化合物、重金属元素、高通量暴露组学E200(医学专用)及微塑料等检测服务)。同时,提供基因组学、蛋白组学、代谢组学等多组学产品服务,从实验设计—样本处理—生信分析—数据应用全链条完整解决方案,帮您高效避坑,突破难点。