深圳市艾斯基因科技有限公司
4 年
手机商铺
- NaN
- 0
- 1
- 0
- 3
推荐产品
公司新闻/正文
Nat Commun | 多模态研究表明:产前双酚A暴露通过表观遗传抑制芳香化酶与ASD相关,且10HDA可改善相关小鼠表型
427 人阅读发布时间:2025-10-22 14:19
自闭症谱系障碍(ASD)以个体在社交沟通和互动方面受损、以及行为模式受限、重复为主要特征,是一种可经临床诊断的神经发育障碍。人群和动物研究表明,产前暴露于双酚A(BPA)等内分泌干扰物与儿童ASD症状相关,但其通过芳香化酶调控神经发育的机制尚不明确。
2024年8月,澳大利亚墨尔本大学研究人员在Nature Communication上发表了题为“Male autism spectrum disorder is linked to brain aromatase disruption by prenatal BPA in multimodal investigations and 10HDA ameliorates the related mouse phenotype”的文章,该研究通过人群队列与多模态实验模型,证明产前BPA暴露会增加男性患ASD的风险,该过程与BPA通过表观遗传抑制芳香化酶基因有关,并在小鼠模型中证实,出生后给予具有雌激素活性的脂肪酸,即10-羟基-2-癸烯酸(10HDA),可改善产前暴露于BPA的幼鼠所出现的ASD表型。

研究设计
采用多模式整合研究设计,通过出生队列研究与动物模型实验相结合,系统探讨了产前BPA暴露与男性ASD风险之间的因果关系及机制。
1、人类队列研究:基于“巴旺婴儿研究”出生队列(BIS队列,1074对母婴),检测母亲孕36周尿 BPA水平,并结合CYP19A1基因遗传评分和脐带血CYP19A1 脑启动子甲基化,分析BPA暴露与ASD诊断的关联,并通过分子中介分析明确芳香化酶甲基化的介导作用;
2、动物实验验证:构建小鼠模型(孕期BPA暴露模型和芳香化酶基因敲除(ArKO)模型),评估雄性小鼠的ASD样行为、脑结构及功能;
3、干预研究:评估10HDA在细胞培养和小鼠模型中对BPA有害效应的逆转作用,包括行为改善、神经元形态恢复及转录组通路调控;
4、分子机制探索:通过体外细胞实验验证BPA对芳香化酶表达的抑制作用,以及10HDA的缓解效应;结合分子对接模拟、RNA测序分析10HDA的作用机制及对神经发育相关基因的调控。
主要结果
在巴旺婴儿研究出生队列中,研究人员分析了43例ASD确诊儿童的产前BPA暴露水平与芳香化酶基因(CYP19A1)活性的关联。构建两种遗传评分方法来评估儿童的芳香化酶活性水平,结果表明,那些芳香化酶活性较低的男孩,若在产前暴露于高水平的BPA,其在2岁时出现ASD相关症状的风险会显著增加(约3.5倍以上)。在按儿童性别和未加权CYP19A1遗传评分进行分层的亚组分析中,结果与2岁时的发现一致,产前BPA高暴露与儿童9岁时被诊断为ASD呈正相关,仅在芳香化酶活性较低的男孩群体中。
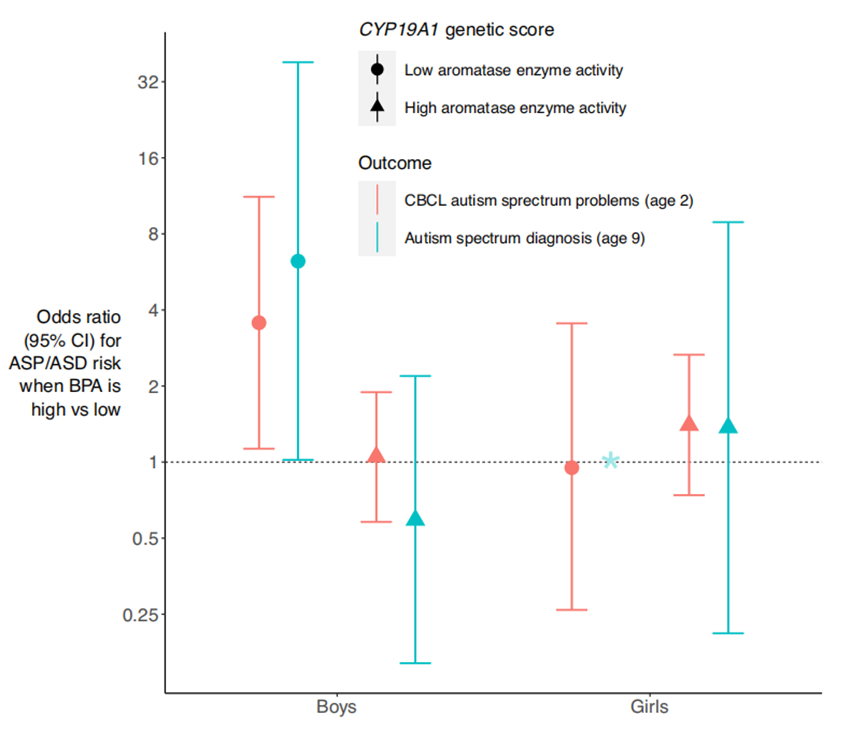
产前BPA暴露与自闭症谱系障碍结果的关联
进一步研究发现,产前高水平BPA暴露可诱导脐带血中CYP19A1基因大脑启动子I.f 区域甲基化水平升高,BPA水平越高,大脑启动子区域的甲基化程度也越高。在调整了与芳香化酶相关的遗传评分后,这种关联依然存在,表明BPA可能通过甲基化这一表观遗传途径,特异性关闭了大脑中芳香化酶的基因开关。
在另一个独立队列中,重新分析数据发现,更高的产前BPA水平同样与芳香酶大脑启动子P1.的的甲基化水平升高显著相关。这增强了BPA导致芳香化酶基因甲基化这一结论的可靠性。
在BIS队列中,研究证实较高的产前BPA暴露同样会导致大脑神经营养因子BDNF基因关键区域发生超甲基化,这种效应主要在男性婴儿中显著。中介分析在两个独立队列中都提供了显著证据:BPA对BDNF甲基化的影响,有一部分是通过“升高芳香酶甲基化”这个中间步骤来实现的。即存在一条BPA-CYP19A1甲基化 ↑ →BDNF甲基化 ↑ 的传导路径。
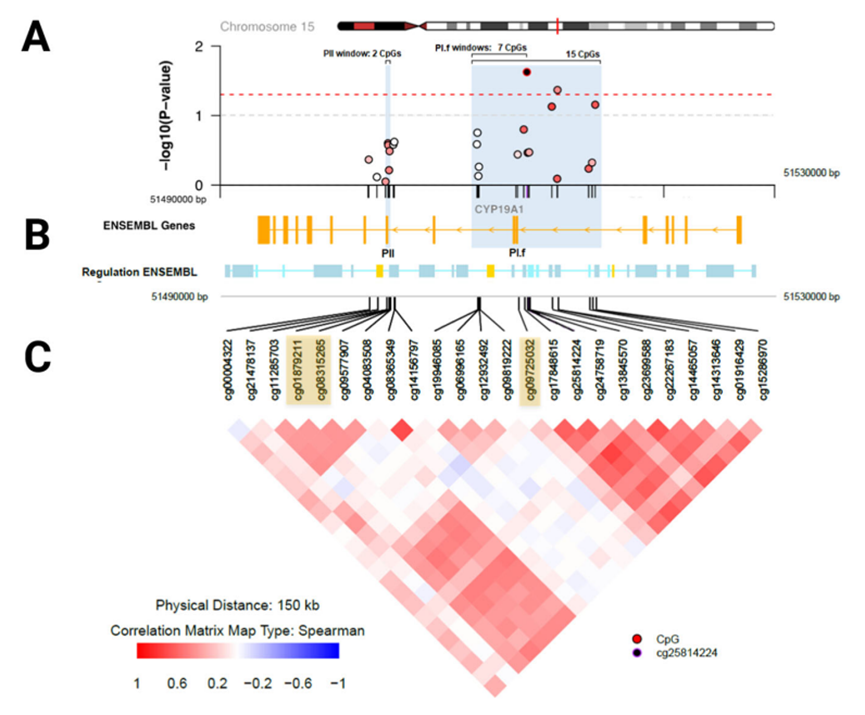
脐带血中与产前BPA相关芳香化酶CYP19A1基因的甲基化
为了验证上述对BPA和芳香化酶表达的人群研究结果,随后通过体外实验研究了BPA暴露对人神经母细胞瘤细胞系SH-SY5Y中芳香化酶表达的影响。在SH-SY5Y中,蛋白表达水平检测结果显示,随着BPA暴露浓度的升高,芳香化酶表达水平逐渐下降,在50 μg/L BPA 处理时芳香化酶蛋白水平减少50%以上,证实了BPA对酶表达的直接抑制作用。
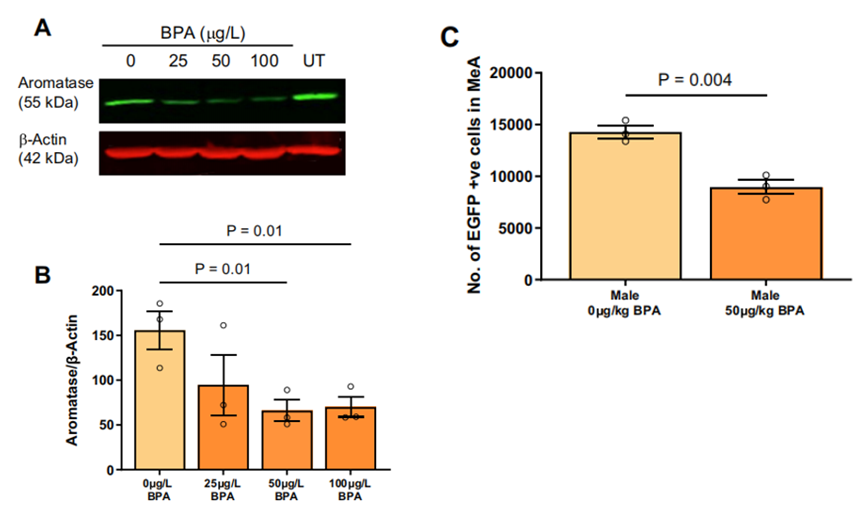
BPA暴露会降低芳香化酶的水平
行为学实验进一步表明,BPA暴露雄性小鼠社交互动时间减少43%,刻板行为增加48%,而芳香化酶敲除(ArKO)雄性小鼠,完全丧失社交偏好(图 4A-B),证实芳香化酶缺失是雄性社交障碍的核心机制。
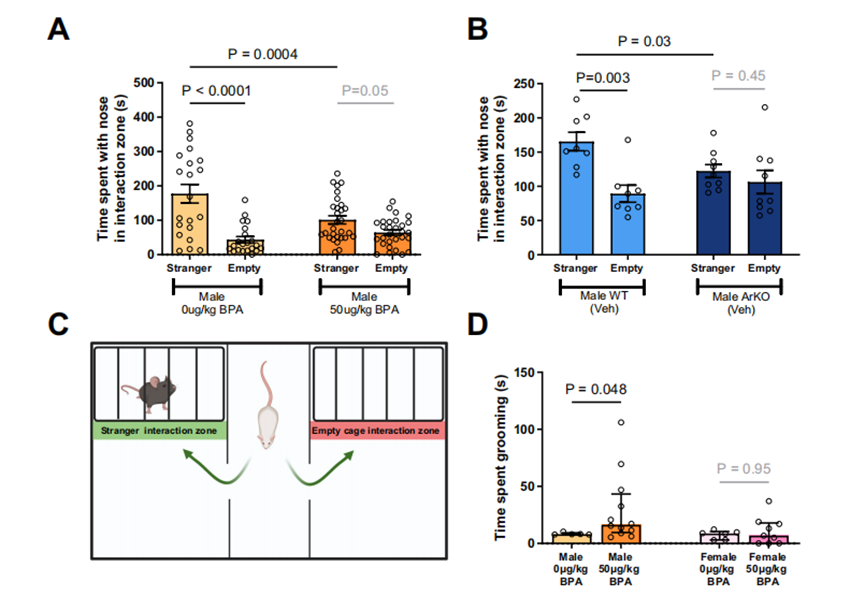
伴随MeA神经元树突长度缩短29.6%、棘密度降低7.0 spines/10μm。皮层电生理检测显示,这些小鼠的γ振荡频率异常,与ASD患者脑电特征一致。
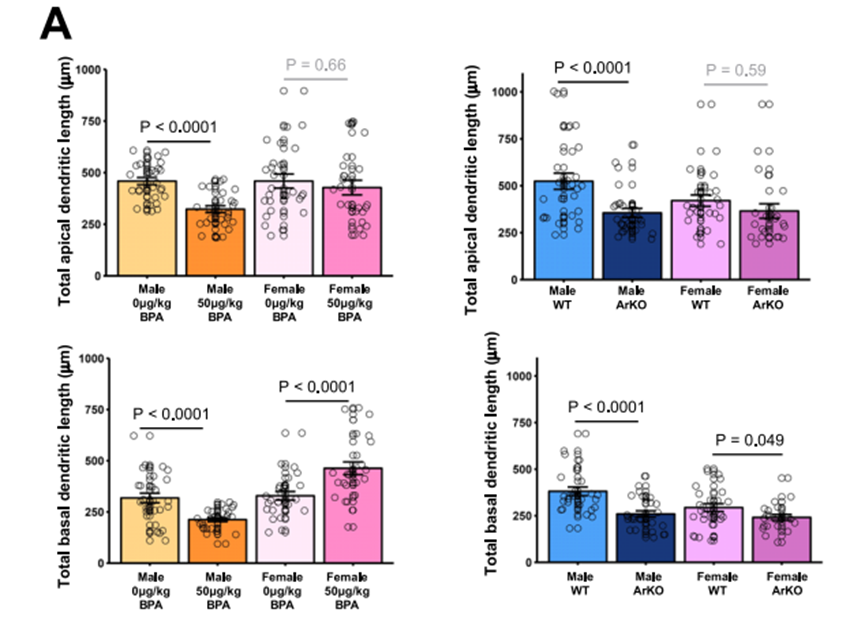
雄性BPA暴露和ArKO小鼠皮层结构和功能的改变
分子对接模拟表明,10HDA可能作为一种配体,在雌激素受体α和β上与BPA竞争结合位点。在雄性胎儿大脑皮层神经元的体外培养实验中证实,BPA会直接损害神经元的正常发育,导致神经突触缩短、棘突密度下降。而10HDA能够有效抵消BPA的这种毒性作用,保护神经元结构。在体内实验中,产后10HDA给药显著改善了产前BPA暴露雄性小鼠的社交互动,并且恢复了ArKO小鼠杏仁核的电活动低下及病理改变等。
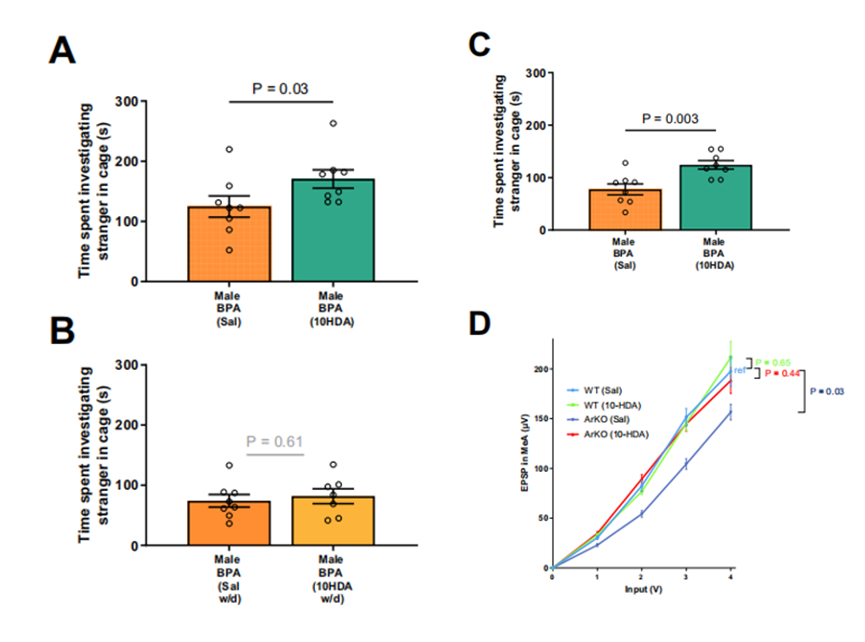
出生后10HDA可改善社会方法和兴奋性突触后电位缺陷
大脑皮层转录组分析显示,10HDA 显著上调BPA暴露而下调的突触发生相关基因,激活CREB信号通路等神经发育关键路径,从基因表达层面揭示其神经保护机制。
这项多模态研究通过出生队列和动物模型研究,揭示了产前BPA暴露通过表观遗传机制抑制大脑芳香化酶活性,从而特异性增加男性ASD表型的分子途径。10HDA可能是一种潜在的治疗剂,它在分子、细胞、环路及行为层面可以全面逆转BPA的神经发育毒性,为ASD的干预提供了潜在新策略,但其安全性和疗效还需要进一步研究。
艾斯基因优品推荐
【艾斯基因创新多组学平台】艾斯基因全力打造赋能基础科研、精准医学以及人群队列的创新多组学检测服务平台,提供基因组学、表观基因组学、暴露组学、蛋白组学、转录组学、代谢组学等多组学产品,从实验设计—样本处理—生信分析—数据应用全链条环节,提供全流程专业咨询和答疑,帮您高效避坑,突破难点。
更多细节,欢迎咨询!